Membran Proteinlerinin, Lipitleri ve İyonları Nasıl Hareket Ettirdiğini Açıklayan İki Makale
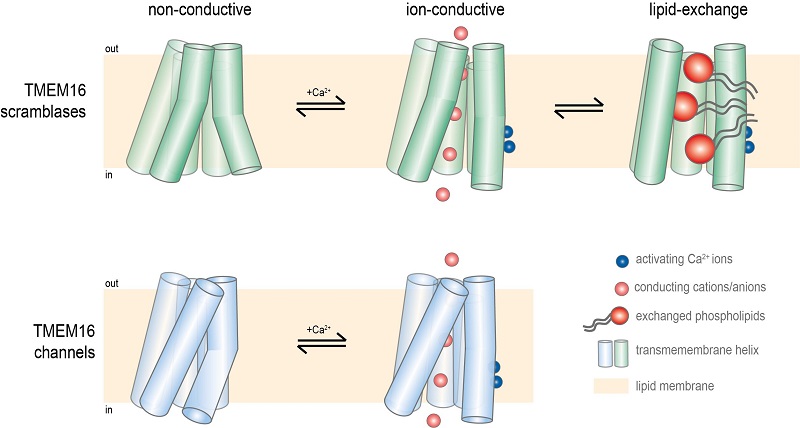
TMEM16 protein ailesinin transmembran kısmının şematik gösterimi. “Scramblase , bir hücre zarının bir lipit iki tabakasının iki mono katmanı arasında fosfolipitlerin translokasyonundan sorumlu bir proteindir.” Üstteki şekil Scramblase Protein; iletim olmayan, iyon iletimi olan, lipit değişimi olan. Alltaki kapalı ve ara konfigürasyona sahip iyon kanalını gösteriyor. Credit: C. Paulino, University of Groningen.
TMEM16 protein ailesi kalsiyum ile aktive olan Klorür kanalları olarak karşımıza çıkmaktadır. Ancak bu ailenin büyük bir kısmının Scramblase protein (Lipit zarın her iki tarafı arasındaki lipitlerin yerini değiştiren ve seçici olmayan iyon iletimini sağlayan) olduğu ortaya çıktı. TMEM16 protein ailesinin hem memeli hem de mantar üyeleri üzerine yapılan yeni bir çalışmada; Cristina Paulino, Hollanda Groningen Üniversitesi'ndeki Yapısal Biyoloji bölümündeki kriyo-EM biriminin yöneticisi ve İsviçre Zürih Üniversitesi'nden meslektaşları, bu protein ailesinin yapıları ve işlevleriyle ilgili yeni bilgiler elde etmişlerdir. Sonuçlar, 12 Mart'ta yayınlanan eLife dergisinde arka arkaya iki makale ile yayınlandı.
1980'lerde, bilim adamları kalsiyum tarafından aktive edilmiş özel klorür kanalları buldular. Bununla birlikte, 2008'e kadar bu kanalların gerçek moleküler kimliğinin TMEM16 ailesine ait olduğu görülmedi.
Paulino, bu kanalların, akciğerlerde ve diğer organlarda klorür taşınmasının hatalı olduğu bir hastalık olan kistik fibrozu tedavi etmek için kullanılabileceğini öne sürmektedir.
Daha sonra, insan genomunda 10 farklı TMEM16 geni bulundu, ancak işlevleri incelendiğinde sonuç sürpriz oldu. "İki gen gerçekten klorür kanalları için kodlandı, ancak geri kalanı Scramblase proteinleriydi – fosfolipitleri, lipit zarın her iki tarafı arasında hareket ettiren proteinler."
Hücre ölümü
Hücre zarlarının lipit bileşimi asimetriktir: İç ve dış mono tabaka farklı fosfolipitler içerir. Spesifik fosfolipitleri, zarın bir tarafından diğerine hareket ettirerek, Scramblase proteinler asimetriyi bozar. Paulino, bunun çok güçlü bir sinyal olabileceğini belirtiyor. Örnek olarak; zarın iç kısmına yerleştirilmiş lipitler, dışarıda bulunduğunda, hücre ölümünü indüklemek için bir sinyal olarak kullanılabileceğini düşünüyor. Veya lipit Scramblase TMEM16F durumunda; trombositlerde kan pıhtılaşmasını başlatmak için. Scramblase aktivitesinin sıkı düzenlenmesi bu nedenle hayati öneme sahiptir. Bununla birlikte, işleri karmaşıklaştırmak için, bu scramblase proteinlerinin bazıları, seçici olmayan iyon kanalları olarak da işlev görür.
Paulino, Raimund Dutzler laboratuvarında, özellikle kanal olarak çalışan TMEM16 ailesinin bir üyesi olan TMEM16A'nın kriyo-EM yapısını çözdü. O, mantarın nhTMEM16 scramblase proteinin X-ışını yapısı ile bu yapıyı karşılaştırıldı. Her iki çalışmada da bu iki işlevli ailenin niteliklerini tanımlandı. Benzer bir protein mimarisinin bu farklı görevleri yerine getirmek için nasıl adapte olabileceğini anlamak için. Lipit scramblase yapısında, lipitlerin kayabildiği zarlarla yayılan ve zar ile erişilebilen bir boşluk gözlemlediğimiz halde, iyonların zar boyunca difüzyonuna izin veren bir gözenek oluşturmak üzere, klorür kanalı yapısındaki oyuk, kapatılır.
Scramblases
Ancak, önemli sorular cevaplanmamıştı: Araştırmacılar, Scramblases'ların kalsiyum tarafından nasıl düzenlendiğini ve bazılarının iyon taşınımını nasıl eş zamanlı olarak kolaylaştırdığını bilmek istediler. Bu amaçla, yeni kurulan Groningen Üniversitesi'nde araştırma grubu ve İsviçre'nin Zürih'teki Dutzler grubu ile birlikte, kan pıhtılaşmasında çok önemli rol oynayan memeli TMEM16F proteinini incelemeye başladı. Açık ve kapalı durumu yakalamak için kalsiyumlu ve kalsiyum içermeyen ortamlarda proteinin yapısını çözdüler. Bununla birlikte, hiçbir kriyo-EM yapısı, fosfolipitlerin ve iyonların taşınabileceği bir boşluk içeren açık bir durum göstermedi. Kalsiyumlu ve kalsiyumsuz yapılarda sadece küçük bir fark vardı.
Araştırmacıların birkaç muhtemel açıklaması var. Ya lipitler, sulu bir boşluk oluşmadan taşınabilir ya da deney koşulları, proteinin 'açık' durumunu benimsemesi için uygun değildi. Mutasyonların farklı yerlerdeki etkisi ilk seçeneğin olası görünmemesini sağladı. Ancak ilerleme kaydetmek için daha fazla bilgiye ihtiyaç vardı. Böylece araştırmacılar, nhTMEM16 mantar proteinleri konusundaki çalışmalarına geri döndüler.
Siyah beyaz değil
Bu deneyler daha başarılı oldu. Paulino ve arkadaşları; fosfolipitleri taşıyabilen bir oluk ile açık bir durum, kapalı bir durum ve iyon taşınmasına izin verebilecek bir ara durum gözlemlediler. Nitekim kalsiyum varlığının, üç durumda da açık duruma sebep olması gerektiğini buldular. Bu nedenle sonuçları; yapının, farklı durumlar arasında bir denge ile oldukça dinamik olduğunu göstermektedir. Aynı zamanda, kalsiyum dışında TMEM16 proteinlerinin aktivitesini düzenleyen ek bir faktör olması gerektiği anlamına gelir, çünkü hücrelerde bu proteinlerin aktivitesi sıkı bir şekilde düzenlenir.
Paulino ve meslektaşları, TMEM16 ailesinin proteinlerinin nasıl çalıştığını anlamada uzun bir yol kat etti. Şimdi bunun siyah beyaz bir durum olmadığını biliyoruz: çoklu protein oluşumları dinamik bir dengededir. Tamamen açık durumda, onlar Scramblases’tır, ara durumdayken iyon tranportu gerçekleştirebilirler. Bu, bu proteinlerin başlangıçta Scramblases olduğunu, ancak bazılarının muhtemelen proteinin ara formunu tercih eden mutasyonlarla saf iyon kanallarına evrimleştiğini göstermektedir.
Dinamik
TMEM16 proteinlerinin karmaşık etki mekanizmasını anlamak için muazzam miktarda yapısal ve fonksiyonel verilere ihtiyaç duyulmuştur. Paulino ve arkadaşları, aktif yapının dinamiklerini örneklememize ve proteinin olabileceği çok sayıda farklı durumu görmeye olanak tanıyan kriyo-EM'in gücünü tekrar doğrulamışlardır.
Çeviren: Barış Uçar, Bilime Yön Veren Cevaplar, The Evolution of Nature's Machines
Kaynaklar: https://phys.org/news/2019-03-papers-membrane-protein-lipits-ions.html?utm_source=nwletter&utm_medium=email&utm_campaign=daily-nwletter 04.04.2019
More information: Valeria Kalienkova et al, Stepwise activation mechanism of the scramblase nhTMEM16 revealed by cryo-EM, eLife (2019). DOI: 10.7554/eLife.44364
Carolina Alvadia et al. Cryo-EM structures and functional characterization of the murine lipit scramblase TMEM16F, eLife (2019). DOI: 10.7554/eLife.44365
Journal information: eLife

Biyolojik Gelişmeler
-
Arkeologlar Korunmuş İnsan Beyinleri Bulmaya Devam Ediyor
-
Yapay Zeka istilacı Asya eşekarılarını tespit etmeye yardımcı oluyor.
-
Avustralya fosili, fotosentezin en az 1,75 milyar yıl önce evrimleştiğini öne sürüyor
-
Böcek kanatlarının solungaçlardan evrimleştiğine dair yeni kanıtlar
-
Denizyıldızının Başı Neresi? Tahmininiz Büyük İhtimalle Yanlış
-
Biyoloji bölümü seçenler ve biyolojiye ilgi duyanlar için bazı öneriler
-
Canlıların Gizemli Dünyasını Keşfetmek: Biyologların Gözüyle Doğa, Genetik ve Evrim
-
Biyolojik ve Kimyasal Silahlar Ne Zamandan Beri Var?
-
Filler Gerçekten ‘Asla Unutmaz’ mı?
-
Sibirya’da Bulunan Ayı Mumyası, Mağara Ayısı Değilmiş
-
California Bilimler Akademisi Bilim adamları 2022'de 146 yeni tür tanımladı
-
Yapay zeka hücre hareketini mikroskop altında analiz edebiliyor.
-
Ağaçlardan Önce Yeryüzünde Devasa Mantarlar Vardı
-
Biyoloji Terimleri Sözlüğü Yayımlandı
-
Avcı-Toplayıcılıktan Tarıma Geçiş Tam Olarak Nasıl Gerçekleşti?