Neisseria meningitidis ve Bakteriyel menenjitler
Bakteriyel menenjitler dünya genelinde - özellikle küçük çocuklarda, beyin hasarı, sekeller ve ölümle sonuçlanabilen ciddi tablolara yol açtıklarından dolayı- halen en önemli enfeksiyöz hastalıklardır. En sık rastlanan üç meningeal patojen olan Neisseria meningitidis, Haemophilus influenzae ve Streptococcus pneumoniae vakaların %80'den fazlasını oluştururlar. Erken ve özgül tanı hasta yönetiminde ve hastalığın kontrolü ile ilgili önlemlerin alınmasında önemlidir. DSÖ bu bakteriyel patojenlerin neden olduğu menenjitlerin ya da invaziv hastalıkların dünya genelinde azaltılması ile ilgili yaygın program yürütmektedir (1,2). Ülkemizde de bu üç patojenin neden olduğu menenjitler ve diğer invaziv hastalıklar bildirimi zorunlu hastalıklar arasında yer almaktadır (3,4).
Bazı klinik özellikleri ile olası etiyoloji akla getirilebilirse de tanı genel olarak klinik bulgular temelinde konulamadığı için bu hastalıkların kesin tanısı mikrobiyolojik incelemeye dayanmaktadır. “Tanı stratejisi”ni ise laboratuvara gelen klinik örneklerden bu üç patojenin saptanması öncelikli olmak üzere bütün olası bakteriyel etkenlerin yakalanabileceği ortak bir tanı akış şemasının izlenmesi
oluşturur (1). Laboratuvar tanısında genellikle direkt mikroskopi, hızlı antijen saptama, kültür ve moleküler tekniklerden yararlanılır. Kesin tanı kültür ile ya da bazı durumlarda antijen saptama yöntemleriyle konabilmektedir.
Neisseria meningitidis fırsatçı patojendir ve nazofarinkste hastalık tablosu oluşturmadan bulunabilir. Ancak kan akımı enfeksiyonu yapıp kan beyin bariyerini geçtikten sonra çoğunlukla menenjit tablosu oluşturur. N.meningitidis menenjit ve meningokoksemi dışında nadir de olsa pnömoni, artrit, supraglottit ve üretrit gibi klinik tablolar da oluşturabilmektedir. Özellikle endemik bölgelere
seyahat edenler, askeri birlikler, kreşler ve bakımevlerinde bulunan duyarlı kişiler risk altındadır.
Hastalığın seyri ölümcül olabileceğinden bakteriyel menenjit etkenlerinin tanısı klinik mikrobiyoloji laboratuvarlarının en önemli tanı fonksiyonlarından biridir. Kesin tanı epidemiyolojik incelemelere de yön vereceği için ayrıca önemlidir.
Bu nedenlerle bu UMS belgesinde, anılan etkenlerden N. meningitidis‟in tanısı için izlenecek akış şeması ile başta kültürlerden izolasyonu olmak üzere, doğru ve güvenilir tanı için geçerli prosedürlerin verilmesi hedeflenmiştir.
Neisseria cinsi bakteriler, Neisseriaceae ailesi üyesi olan, genellikle çiftler şeklinde bulunan 0.6x0.8 μm boyutlarında gram negatif diplokoklardır. Aynı ailenin üyesi olan Kingella, Eikenella, Simonsiella ve Alysiella cinsleri ile beraber sınıflandırılırlar (5).
Neisserialar zor üreyen bakteriler olduklarından, laboratuvarda elde edilebilmeleri için uygun besiyeri ve üreme ortamının sağlanması gerekmektedir. Optimal 35- 37°C sıcaklık ve %5-10 CO2‟li ortamda ürerler. Uygun besiyerinde saydam, pigmentsiz, hemoliz yapmayan 1-5 mm çapında koloniler oluştururlar. Kapsül varsa düz olmaktan ziyade mukoiddirler. Otoliz olduğundan eskimiş kültürlerinin şekil ve büyüklüklerinde değişiklikler görülebilmektedir (6).
N. meningitidis polisakkarti kapsülün kimyasal yapısına göre seroaglütinasyon ile A, B, C, D, X, Y, Z; E, W-135, H, I, K ve L olmak üzere 13 farklı serogruba ayrılmaktadır. Grup A ve C polisakkaritleri insanlarda immünojeniktir ve yapılan aşı çalışmaları bunu göstermektedir. Ancak grup B polisakkaritinin pürifiye edilmiş olmasına rağmen insanlarda yeterli immünojenik reaksiyon oluşturmadığı anlaşılmıştır ve henüz grup B için aşı üretilememiştir (6).
Meningokokların dış membran yapısı diğer gram negatif bakterilerin yapısına benzemektedir. Patogenez ve immünobiyolojiden sorumlu birçok somatik antijen içermektedir. Ana antijenler gram negatif bakteri lipopolisakkariti analoğu olan LOS‟ler ve dış membran proteinleridir (6).
Neisseria meningitidis, menenjitin en önemli etkenlerinden biridir ve aynı zamanda meningokoksemi ve değişik oranlarda pnömoni, artrit, supraglottitis ve üretrit gibi klinik tablolara neden olabilmektedir (7). Meningokoklar, geniş çaplı epidemilere yol açabilme potansiyeli nedeniyle ile diğer bakteriyel menenjit etkenlerinden farlılık göstermektedir. Bu nedenle meningokokların yol açtığı menenjit tablosu, epidemik menenjit olarak da adlandırılmaktadır.
Hastalığın tarihçesine bakıldığında epidemik serebrospinal ateşin (meningokokal menenjit) ilk kez Cenova‟da 1805 yılında Vieusseaux tarafından tanımlandığı görülür (8). 1887 yılında Weichselbaum bakteriyi BOS‟dan izole etmiş ve organizma ile epidemik menenjit arasında bir ilişki olduğunu göstermiştir. Serogruplar ilk kez 1909 yılında Dopter tarafından tanımlanmıştır. 1928, 1930 ve 1941 yıllarında önemli yerel ve uluslararası salgınlar gözlenmiştir (6).
Afrika, Yeni Zelanda ve Singapur‟daki epidemiler bu hastalığın halen tüm dünyada önemli bir sağlık sorunu olduğunu göstermektedir. Vakaların büyük bir bölümünü çocuklar oluşturmaktadır. 1939 ile 1962 yılları arasında dünyada yaklaşık 100.000‟i ölümle sonuçlanan 600.000 meningokokkal hastalık vakası bildirilmiştir. Salgınlar özellikle toplu yaşamın olduğu askeri kamplar, çocuk bakım merkezleri, okullarda ve üniversitelerde gelişmiştir (6).
Dünyada bölgesel olarak serogrup dağılımı değerlendirildiğinde Güney Amerika kıtasında C (%57), Amerika‟da C (%31), Kanada‟da B (%54), Avrupa‟da B (%76), Avustralya‟da B (%84), Yeni Zelanda‟da B (%83), Tayvan‟da B (%52) ve Afrika‟da A (%91) en sık izole edilen serogruplardir. Serogrup W-135 Afrika‟dan %8, Amerika‟dan %12 oranında bildirilmiştir (9).
Afrika kıtasında yer alan ve menenjit kuşağı olarak bilinen ülkelerden Hac görevi nedeniyle çok sayıda kişi Mekke ve Medine‟ye gitmektedir. Ülkemizden de Hac nedeniyle bu bölgeye yılda ortalama 150 000 kişinin gittiği göz önüne alındığında Hac ziyaretinin etken bakteri ile karşılaşma olasılığı bakımından risk faktörleri arasında olduğu söylenebilir. Nitekim Hacca giden kişilerde 2000-2001 yıllarında N.meningitidis W-135 ile uluslararası düzeyde bir epidemi meydana gelmiştir. Bu salgınlarda Hac klonu olarak bilinen N. meningitidis serogrup W-135‟un sekans tip (ST)-11 klonunun baskın olduğu tespit edilmiştir (10). Aynı klon daha sonraki
dönemlerde de dünyanın çeşitli ülkelerinde menenjitli hastalardan izole edilmiştir(11). 2000 yılında ortaya çıkan salgında Hac ziyaretinden dönen kişiler ve onlar ile yakın temasta bulunan 10 ülkeden 400 kişide N. meningitidis W-135 izole edilmiştir. 2001 yılında ise bu oran nispeten azalmış ve 200‟e düşmüştür (11,12)
N. meningitidis serogrup W-135 tüm dünyada olduğu gibi Türkiye‟de de menenjit ve kan akımı enfeksiyonlarına neden olmaktadır. Hac klonu olarak da bilinen serogrup W-135 ST-11 klonu 2004 yılında iki menenjitli ve iki taşıyıcı askerden (13), 2006 yılında iki taşıyıcı askerden (14), 2007-2008 yılında ise bir menenjitli vaka ile bir taşıyıcı kişiden izole edilmiştir (15).
Türkiye‟de ayrıca W-135‟in ST-2754 klonu ile de enfeksiyon bildirilmiştir; 2003 yılında menenjitli bir hastadan ilk kez izole edildikten sonra 2004 yılında menenjitli bir hastadan (13), 2006 yılında menenjitli hasta ve bir taşıyıcıdan (14), 2007-2008 yılında bir menenjitli hasta ve iki taşıyıcıdan izole edilmiştir (16).
Türkiye‟de hakim serogrupları belirlemek için yapılan çalışma sonuçları birbirlerinden farklılık göstermektedir. 1996 yılında 120 kişi ile yapılan çalışmada serogrup B (%47.5) (15), 1997 yılında yapılan çalışmada serogrup C (%27.8) (17) ve 2005‟de ise serogrup Y/W-135 (%37.5) en sık izole edilen serogruplar olarak bildirilmiştir.
Ülkemizde B ve W-135 ile ilişkili hastalık tabloları sık olarak görülmekte olup A ve Y nadirdir (18). Son dönemde serogrup X sekans tip 767 ile ilişkili bir vaka ve taşıyıcılık bildirilmiştir (19).
Çalışmalarda N. meningitidis‟in ABD‟de ikinci sıklıkla toplum kaynaklı menenjitlere neden olduğu gösterilmiştir. ABD‟de menenjitlere bağlı mortalite oranı %13‟tür (6).
N. meningitidis insanlarda çeşitli klinik tablolara neden olabilir. Eğer menenjit şiddetli değilse hastada ateş ve genel enfeksiyon bulguları vardır. Çok küçük çocuklarda sadece ateş, kusma gibi özgül olmayan belirtiler olabilmektedir. Eklem bulguları ve peteşial döküntüler genel olarak meningokokal enfeksiyonlarda oluşmaktadır. Birkaç saatlik ateş ve halsizlik sonunda şiddetli baş ağrısı, sert boyun, kusma, parlak ışığa karşı hassasiyet gibi tipik menenjit semptomları ortaya çıkmaktadır (18). Bu hastalarda işitme hasarı ve artrit sık olarak bildirilirken nörolojik sekel sıklığı düşüktür.
Meningokok sağlıklı bireylerde 12 saatten daha az bir zamanda hayatı tehdit eden sepsis tablosuna neden olabilmektedir. Yaklaşık olarak menenjitli hastaların %30‟unda fulminant sepsis tablosu oluşmaktadır (7). Hastalığın tipik bir klinik belirtisi birden fazla organı da içeren küçük damarların trombozudur. Gövde ve alt ektremitelerde sık görülen küçük peteşiyal deri lezyonları birleşerek büyük hemorajik lezyonları oluşturabilmektedir. İlerleyen dönemlerde şok ile seyreden şiddetli yaygın damar içi pıhtılaşma özellikle genç hastalarda çift taraflı adrenal bez harabiyetine (Waterhouse Friderichsen sendromu) neden olabilmektedir (6,20)
N. meningitidis ek olarak pnömoni, artrit, supraglottitis ve üretrit gibi klinik tablolar oluşturabilmektedir. Meningokokkal pnömoni 80 yıldan daha uzun bir zamandan beri bilinmektedir. Fakat sepsis ile birlikte nadir olarak görülmektedir (21). Supraglottit meningokokun nadir klinik görünümüdür (22). Meningokoklar üretrit etkeni olarak üretradan da izole edilmişlerdir ve etkenin oral seks ile kazanıldığı düşünülmektedir. Organizma homoseksüel erkeklerde orofarinks örneklerinden %93, rektal sürüntülerden %6 ve üretradan %1 oranında izole edilmiştir (23).
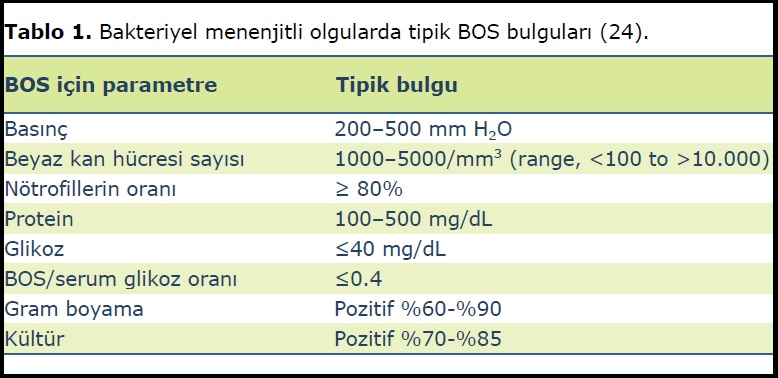
Menenjit şüphesinde tanıda ilk seçenek BOS‟un incelenmesidir. Bakteriyel menenjitli olgularda BOS‟un incelenmesine dayalı tipik BOS bulguları Tablo 1‟de özetlenmiştir (24).
Meningokokkal hastalık şiddetli seyredebilen “acil” bir klinik durumdur. Menenjit şüpheli bir hastadan BOS örneği de klinik laboratuvarlar için “acil” örnek olarak tanımlanmaktadır. Örneğin bir an önce işleme alınması, etiyolojik ajanı saptamak üzere özgül mikrobiyolojik tanı sürecinin bir an önce başlatılması kuraldır (25).
Meningokokkal hastalık şüphesinde, BOS ve kan öncelikle seçilecek örneklerdir. Varsa, peteşiyal döküntülerden kazıntı veya aspirat örnekleri de tanıda çok değerlidir. Gerekirse lokalize enfeksiyonların tanısı için eklem sıvısı ve biyopsi örnekleri de incelenebilir. Mikroorganizma her ne kadar nazofarinkse yerleşip buradan yayılabiliyorsa da menenjit vakalarının tanısında nazofarinks veya orofarinks örnekleri kullanılmaz.
BOS‟un Gram boyalı yaymalarının incelenmesi bakteriyel menenjitli hastaların %60-90‟ında organizmanın hızlı ve doğru bir şekilde tanımlanmasına izin verir ve yaklaşık %100 bir özgüllüğe sahiptir (24). Gram boyamanın duyarlılığı (organizmanın saptanması olasılığı) BOS‟taki bakteri yoğunluğu ile yakından ilişkilidir; eğer mililitrede 103 veya daha az bakteri mevcut ise Gram yaymaların ancak %25 kadarı pozitif bulunabilirken, bakteri yoğunluğu 105 ve daha fazla olduğunda pozitif sonuç elde edilen vakaların oranı %97‟ye kadar yükselmektedir (Tablo 1).
Gram boyamanın klinik yararlılığı aynı zamanda bakteriyel patojene de bağlıdır: S.pneumoniae'nin neden olduğu menenjit vakalarının %90‟ında, H. influenzae vakalarının %86‟sında, N. meningitidis vakalarının %75‟inde, gram negatif basillerin neden olduğu vakaların ise %50‟sinde BOS‟un Gram yaymasında bakteriler gözlenirken bu oran L. monocytogenes menenjitli vakaların %50‟den azında pozitiftir (24). Eğer antimikrobiyal tedavi başlanmış ise bakterinin Gram yaymasında görülme olasılığı da kültürden izolasyon oranı da hızla düşmektedir.
Özetle, meningokok menenjiti şüphesinde BOS‟un Gram yayması mutlaka incelenmelidir. Döküntü ile seyreden hastalıkta peteşiyal örneklerden yaymalar da Gram boyası ile boyanmalıdır. Ayrıca ve eğer mümkünse, bir BOS yayması da Loeffler‟in metilen mavisi ile boyanmalıdır. Özellikle H.influenzae gibi naif ve Gram boya ile zayıf boyanabilen bakteriler BOS‟un sıvısal ve hücresel matriksi içinde kolay ayırt edilemeyeceği için gözden kaçabilmektedirler. Metilen mavisi bu olasılığı bertaraf etmek için iyi bir alternatiftir. Fagositlerin içinde ve/veya dışında gram negatif diplokokların görülmesi tanıyı güçlü bir şekilde destekler.
İnflamatuvar hücrelerin varlığı tanısal değere sahip olduğundan (ör., fulminan, hızlı fatal hastalıkta; çok sayıda organizma ve az sayıda inflamatuvar hücre mevcuttur) klinisyene Gram boyamanın sonucunun yanında inflamatuvar hücrelerin nicelliği hakkında da bilgi verilmelidir.
BOS, serum ve idrarda meningokokların kapsüler polisakkaritlerinin saptanması temeline dayanan direkt testler mevcuttur. Fakat bu testlerin duyarlılık problemleri yeterince çözülmemiştir. Gram boyama ile karşılaştırıldıklarında klinik yararlılıkları tartışmalıdır. Bu testler uygulanıyor olsa bile mikroskopik incelemenin yerine konamayacağı, örneklerden mikroskopik incelemenin de yapılması gerektiği vurgulanmaktadır (20).
Bakteriyel menenjit şüphesinde patojen ajanın izolasyonu için öncelikle BOS (ve invaziv enfeksiyon şüphesi de varsa kan) örneklerinin kültürleri yapılır.
Kültürler için seçilecek besiyerleri potansiyel mikroorganizmaların en büyük kısmının (mümkünse hepsinin) izolasyonunu sağlamayı hedeflemelidir. Bir diğer ifade ile başlangıçta etkenin ne olduğu bilinmediğine göre, öyle bir besiyeri kombinasyonu kullanılmalıdır ki başta olguların %80‟inden sorumlu üçlü (N.meningitidis, H. influenzae ve S.pneumoniae) rahatlıkla izole edilebildiği gibi diğer bakteriyel patojenlerin çoğu da yakalanabilsin (1).
Bu temel strateji ile hareket edildiğinde başlıca şu hususların dikkate alınması gerekir. Öncelikle BOS‟da bulunan organizma yoğunluğu çok düşük olabileceği için örneğin -eğer örnek yeterli miktarda ise- konsantre edildikten sonra ekilmesi önerilir (1).
N. meningitidis güç üreyen bir bakteridir ve en iyi kanlı veya çikolata agar gibi zengin besiyerlerinde ve CO2‟li ortamda ürer. H. influenzae daha zor bir bakteridir ve üremek için ortamda hemin (X faktör) ve nikotinamid adenin dinükleotid (NAD, V faktör) bulunması gerekir. Standart besiyeri at kanı ile hazırlanmış çikolata agardır ve bakteri için bu faktörleri temin eder. Eğer ticari olarak temin edilebilen IsoVitaleX, Supplement B veya Vitox gibi maddeler de eklenebilirse besiyeri H.influenza izolasyonu için ideal hale gelir. S. pneumoniae ise hem kanlı agarda hem de çikolata agarda rahat üreyebilen bir bakteridir. Özetle, kanlı ve çikolata agar birlikte kullanıldığında bakteriyel menenjit patojenlerinin yakalanması için asgari en iyi besiyeri kombinasyonu kullanılmış olur (1).
N. meningitidis tanısında kültür „altın standart‟tır. BOS ve benzeri steril vücut sıvıları çikolata agar ve koyun kanlı agara ekilir ve 35°C‟de %5–7 CO2‟li ortamda (CO2 inkübatörü, mumlu jar) inkübe edilir. Plaklar 24, 48. ve 72. saatlerde üreme varlığı bakımından incelenir ve eğer şüpheli koloniler varsa tanımlama için kan ve çikolata agara pasajlar yapılarak sonraki tanımlama basamaklarına geçilir (20).
N. meningitidis enfeksiyonu dolaşım sisteminin invazyonu ile de seyredebildiği için hastalardan kan kültürü tanıda diğer önemli seçenektir. Ancak, besiyerlerinde bulunan antikoagülan SPS (sodyum polyanetol sulfonat) Neisseria‟ların üremesini engelleyebileceğinden dolayı meningokokkal enfeksiyon şüphesinde kan kültürü yapılacaksa besiyerine steril jelatin (son konsantrasyon %1 olacak şekilde) eklenerek ya da kan örneğinin lizis-santrifügasyonu ile nötürlenmesi gerektiği akılda tutulmalıdır. Kan kültürü şişeleri de aynı inkübasyon şartlarında inkübe edilirler ve üreme sinyalini takiben çikolata agar ve koyun kanlı agara pasajlanarak takip edilirler.
N. meningitidis kolonileri gonokok kolonileri ile karşılaştırıldığında daha büyüktür ve genellikle 18–24 saatlik inkübasyon sonrası 1 mm‟lik çapa ulaşırlar. Koloniler alçak ve konvekstir, düz, nemli kenarları ve parlak yüzeyleri vardır. Koyun kanlı agarda, koloni görünümleri genellikle gri iken, kalın kapsüllü kökenler mukoid görünümde olabilirler. Kolonilerin ürediği bölgede yoğun üremeye bağlı olarak gri-yeşil bir renk oluşumu görülür. Taze kültürlerin görünümü düzgün olmasına rağmen, eski kültürler otolizden dolayı yapışkandırlar.
N. meningitidis‟in şüpheli kolonilerden tanımlanmasında asit üretimi testi veya kromojenik enzim substrat testleri kullanılmaktadır. N. meningitidis glikoz ve maltoza etki ederken, sukroz, früktoz veya laktoza etki etmez.
Serogruplandırma için lam aglütinasyon testi kullanılmaktadır. N. meningitidis izolatları, OMP ve LOS antijenleri temel alınarak serotiplendirilebilir ve altserotiplendirilebilir. Meningokok izolatları, sınıf 2 ve 3 dış membran proteini veya Por B antijenleri temel alınarak 20 serotipe, sınıf 1 dış membran proteini antijenleri (PorA) temel alınarak 10 serosubtipe ve LOS antijenleri temel alınarak 13 immunotipe ayrılabilmektedir (20).
Nazofaringeal sürüntü örneklerinin klinik vakaların tanısında değeri yoktur. Eğer epidemiyolojik amaçlar için taşıyıcılık araştırması yapılacaksa nazofarinks sürüntü örneklerinin kültürleri yapılabilir. Böyle örneklerin kültürleri için florada bulunan bakterileri baskılayacak uygun antibiyotikleri içeren besiyerleri kullanılır (20).
Mikroskopi ve antijen saptama testleri genel olarak duyarlılıkları düşük yöntemlerdir. Örnek alınmadan önce çoğu hastaya antibiyotik başlandığı için mikroskopi ve kültürün başarısı hayli azalmaktadır. Bu yüzden son yıllarda PCR gibi DNA temelli tanı yöntemlerinin önemi artmıştır. PCR ile örnekteki organizma canlı olmasa bile DNA‟sı tespit edilebilmektedir. Öte yandan henüz meningokok nükleik asitlerinin klinik örneklerde saptanmasına yönelik standardizasyonu tamamlanmış ve klinik laboratuvarlarda rutin uygulanabilen bir yöntem mevcut değildir. Bazı real-time PCR uygulamaları vardır (20,26).
Kaynaklar:
1 Perilla MJ, Ajello G, Bopp C et al. Manual for the laboratory identification and antimicrobial susceptibility testing of bacterial pathogens of public health importance in the developing world. Haemophilus influenzae, Neisseria meningitidis, Streptococcus pneumoniae, Neisseria gonorrhoeae, Salmonella serotype Typhi, Shigella, and Vibrio cholera. Centers for Disease Control and Prevention (CDC) and World Health Organization (WHO), 2003.
2 Popovic T, Ajello G, Facklam R. Laboratory manual for the diagnosis of meningitis caused by Neisseria meningitidis, Streptococcus pneumoniae and Haemophilus influenzae. WHO/CDS/CSR/EDC/99.7, 1999.
3 Bulaşıcı Hastalıklar Sürveyans ve Kontrol Esasları Yönetmeliğinde Değişiklik Yapılmasına Dair Yönetmelik. Resmi Gazete; 02.04.2011 – 27893. http://www.resmigazete.gov.tr/eskiler/2011/04/20110402-3.htm (son erişim tarihi: 06.01.2014).
4 Bulaşıcı Hastalıkların Ġhbarı ve Bildirim Sistemi, Standart Tanı, Sürveyans ve Laboratuvar Rehberi, Sağlık Bakanlığı Ankara. 2004. http://www.shsm.gov.tr/public/documents/legislation/bhkp/asi/bhibs/BulHastBilSistStanSurveLabReh.pdf (son erişim tarihi: 18.12.2013)
5 Brooks Gf, Carroll KC, Butel J, Morse S, Mietzner T. The Neisseriae. In: Jawetz E, Melnick JL, Adelberg EA (eds). Medical Microbiology. 25th ed. McGraw-Hill Medical, New York. 2010.
6 Apicella MA. Neisseria meningitidis. In: Mandell GL, Bennett JE, Dolin R (ed.). Mandell, Douglas, and Bennett’s Principles and Practice of Infectious Diseases. 7th Edition. Elsevier, Philadelphia. 2010, p. 2737-2752.
7 Harvey RA, Champe PC, Fisher BD. Neisseriae. In: Lippincott's Illustrated Reviews: Microbiology. 2nd ed., Lippincott Williams & Wilkins, Philadelphia. 2007, p.101-109.
8 Janda W, Gaydos C. Neisseria. In: Murray PR, Baron EJ, Jorgensen JH(eds). Manual of Clinical Microbiology. 9th ed., ASM Press, Washington D.C. 2007, p. 601-620
9 Halperin SA, Bettinger JA, Greenwood B, et al. The changing and dynamic epidemiology of meningococcal disease. Vaccine 2012;30 (Suppl 2):B26-36.
10 Caugant DA, Nicolas P. Molecular surveillance of meningococcal meningitis in Africa. Vaccine 2007; 3: 8-11.
11 Mayer LW, Reeves MW, Al-Hamdan N, et al. Outbreak of W135 meningococcal disease in 2000: not emergence of a new W135 strain but clonal expansion within the electophoretic type-37 complex. J Infect Dis 2002;185:1596-1605.
12 World Health Organization. Meningococcal disease, serogroup W135 (update). Wkly Epidemiol Rec 2001;76:213-214.
13 Kilic A, Urwin R, Li H, Saracli MA, Stratton CW, Tang YW. Clonal spread of serogroup W135 meningococcal disease in Turkey. J Clin Microbiol 2006; 44: 222-224.
14 Kilic A, Jolley KA, Gul HC, et al. Genetic and antigenic characterization of Neisseria meningitidis strains isolated from Turkish recruits in 2006. Intern Med 2008;47:1949-1950.
15 Ercis S, Köseoğlu Ö, Salmanzadeh-Ahrabi S, Ercis M, Akın L, Hasçelik G. Ankara ili Çankaya ilçesi okullarındaki sağlıklı çocuklarda nazofaringeal Neisseria meningitidis taşıyıcılık prevalansı, serogrup dağılımı ve antibiyotik direnci. Mikrobiyol Bul 2005;39(4):411-20.
16 Kılıç A, Jolley KA, Beşirbellioğlu B, Koçak N, Bedir O, Eyigün CP, Başustaoğlu AC. Bir askeri hastanede fatal menenjit etkeni olarak izole edilen Neisseria meningitidis serogrup W-135 suşlarının genotipik özellikleri. Mikrobiyol Bul 2009; 43: 515-517.
17 Punar M, Çağatay AA, Özsüt H, Eraksoy H, Çalangu S, Dilmener M. Ġstanbulda bir ilkokulda asemptomatik Neisseria meningitidis taşıyıcılığı. Klimik Derg 2001;14(1):17-18.
18 Dinleyici EÇ. Yeni meningokok aşıları. ANKEM Derg 2012;26(Ek 2):50-60.
19 Kilic A, Bedir O, Basustaoglu AC, et al. Neisseria meningitidis serogroup X sequence type 767 in Turkey. J Clin Microbiol 2010;48(11):4340-1.
20 Elias J, Frosch M, Vogel U. Neisseria. In: Versalovic J, Carroll KC, Funke G, Jorgensen JH, Landry ML, Warnock DW (eds). Manual of Clinical Microbiology. 10th ed., ASM Press, Washington D.C. 2011, p. 559-573
21 Marrazzo JM, Handsfield HH, Sparling PF. Neisseria gonorrhoeae. In: Mandell GL, Bennett JE, Dolin R (ed). Principles and Practice of Infectious Diseases. 7th ed., Elsevier, Philadelphia. 2010, p. 2753-2770
22 Schwam E, Cox J. Fulminant meningococcal supraglottitis: An emerging infectious syndrome? Emerg Infect Dis 1999;5:464-467.
23 Salet IE, Frasch CE. Seroepidemiologic aspects of Neisseria meningitidis in homosexual men. Can Med Assoc J 1982;126:38-41.
24 Tunkel AR, Scheld WM. Acute meningitis. In: Mandell GL, Bennett JE, Dolin R (Eds). Principles and Practice of Infectious Diseases. 6th ed. Churchill Livingstone, Chapter 80; 2005
25 York MK. Cerebrospinal Fluid Cultures. In: Garcia LS (ed. in chief). Clinical Microbiology Procedures Handbook. 2nd ed. update, ASM Press, Washington D.C. 2007, p. 3.7.1 - 3.7.7
26 CDC. Chapter 10: PCR for detection and characterization of bacterial meningitis pathogens: Neisseria meningitidis, Haemophilus influenzae, and Streptococcus pneumoniae. Second edition, CDC and WHO. 2011. http://www.cdc.gov/meningitis/lab-manual/chpt10-pcr.html (son erişim
tarihi 06.01.2014).
Mikrobiyoloji Laboratuvarı
-
Ehrlich-Ziehl-Neelsen (EZN) Boyama Yöntemi Nedir?
-
Mantarların Boyanması
-
Laktofenol Pamuk Mavisi Boya Solüsyonun Hazırlanışı
-
Flagella Boya Solüsyonun Hazırlanışı
-
Bakterilerde Kirpik Boyama İçin Preparat Hazırlanması
-
Spor Boyama Solüsyonlarının Hazırlanması
-
Schaffer Fulton Yöntemi ile Spor Boyama
-
Ehrlich – Ziehl – Neelson Boyamada Kullanılan Solüsyonlarının Hazırlanışı
-
EHRLICH - ZIEHL-NEELSEN BOYAMA YÖNTEMI
-
Besiyeri Hazırlamada Kullanılan Araç Gereçler Nelerdir?
-
Karbonhidrat Fermantasyon besiyeri formül ve hazırlanış bilgileri
-
TSİ (Üç şekerli Demirli Agar) besiyeri formül ve hazırlanış bilgileri
-
Çikolata Agar Besiyeri formül ve hazırlanış bilgileri
-
Kanlı Agar Besiyeri formül ve hazırlanış bilgileri
-
Löwenstein- Jensen Besiyeri formül ve hazırlanış bilgileri