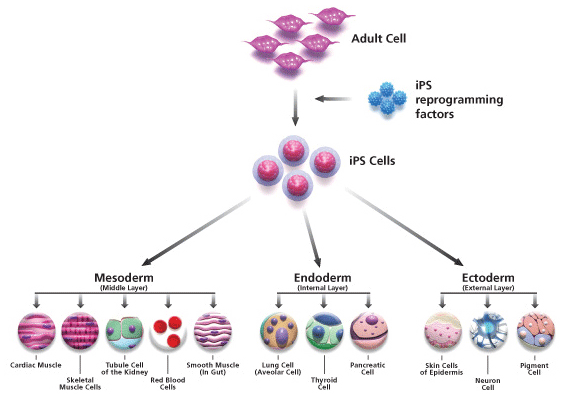
İndüklenmiş pluripotent kök hücreler
İnsan iPSC'lerinin hücre akıbetini kontrol etmek için kullanılan geniş bir hücre kültürü ortamı koleksiyonu, takviyeleri, biyoaktif küçük moleküller ve büyüme faktörleri sunuyoruz. Aşağıdaki tablo, insan iPSC'lerini farklı hücre soylarına ayırmak için kullanılan en yaygın şekilde kullanılan protokolleri, ortamları ve karakterizasyon antikorlarını vurgulamaktadır.
İndüklenmiş pluripotent kök hücrelerin (İPKH) hikayesi yaklaşık 60 yıl önce Philadelphia’dan Briggs ve King ile Cambridge’den Gurdon isimli araştırmacıların, kurbağa yavrusu barsak hücre çekirdeklerini, çekirdeği çıkarılmış kurbağa yumurtalarına transplante etmeleri ile başlamıştır (85).
Transplante edilen yumurtalar donör nükleusları ile genetik olarak aynı kurbağa yavrularını oluşturmuştur. Bu çalışma, alıcı yumurta sitoplazmasının transplante edilen çekirdeği bir şekilde sağlıklı erişkin kurbağaya çevirebilecek potansiyeli sağladığı gerçeğini ortaya çıkarmıştır. “Somatik hücre nükleer transferi” (Somatic cell nuclear transfer) adı verilen bu deney 1990’lı yıllarda memeli türlerinde de denenmiş ve meşhur koyun Dolly’nin klonlanmasını sağlamıştır (86). 2006 yılında ise, Takahashi ve Yamanaka embriyonel kök hücrelerin (EKH) pluripotensi ve kendini yenileme özelliğini sağlayan 24 faktör üzerinde çalışma yapmışlardır. Oct4 (Octamer 3/4), Sox2 (SRY box-containing gene 2), Klf4 (Kruppel-like factor 4) ve c-Myc kombinasyonunun retrovirüs aracılığı ile eksprese edilmesinin fare fibroblast hücrelerini yeniden programlamak için yeterli olduğunu göstermişlerdir ve bu hücrelere İPKH adı verilmiştir (87). Akabinde, belirtilen kombinasyondaki faktörlerin aynı yöntemle insan fibroblast hücrelerini de yeniden programladığını rapor etmişlerdir (88). Aynı zamanda başka gruplar da, Oct4, Sox2, Nanog ve LIN28A’dan oluşan farklı kombinasyonlarla İPKH’ler elde etmişlerdir (89,90). Bu dönüm noktası çalışmaları nedeniyle Shinya Yamanaka ve Sir John Bertrand Gurdon’a, 2012 yılında Fizyoloji ve Tıp alanında Nobel Ödülü verilmiştir.
Pluripotent özellik nedir?
Pluripotent Kök Hücre Özellikleri
- Kendisini yineleme ve sürdürme
- Artma
- Farklılaşmış dokulara ait hücreleri oluşturabilme
- Hasar gören dokuyu onarabilme olarak sıralanır.
Kök hücreler farklılaşma potansiyellerine göre unipotent, multipotent, pluripotent ve totipotent olarak gruplandırılırlar [32,33]. Unipotent kök hücreler bir tek farklılaşmış hücre tipini oluşturabilirler. Totipotent kök hücreler tüm embriyonik dokulardaki özelleşmiş hücrelerle birlikte plasenta gibi ekstraembriyonik dokulara farklılaşarak tam bir organizmayı oluşturabilirler [34]. Multipotent kök hücreler ise genelde kendileriyle aynı embriyonik tabakayı temsil eden, sınırlı sayıda hücre tipine farklılaşabilme potansiyeline sahiptirler [32]. Pluripotent özellik üç embriyonik tabakayı (endoderm, mezoderm, ektoderm) temsil eden hücre tiplerine farklılaşabilme özelliği olarak tanımlanabilir. Embriyonik kök hücreler pluripotent olmalarının yanında sınırsız çoğalma ve kendi kendilerini yenileyebilme özellikleri ile birçok hastalığın tedavisinde kullanılabilecek somatik hücre stoğunu üretmekte kullanılabilirler [1]. Embriyonun blastosist evresindeki iç hücre kitlesinden elde edilen embriyonik kök hücreler endoderm, ektoderm ve mezodermi temsil eden hücre tiplerine farklılaşabilir ve hepatositler, sinir hücreleri, kalp kası hücreleri gibi terminal farklılaşmasını tamamlamış hücre tiplerini oluşturabilirler (Şekil 1).

Şekil 1.Embriyodan pluripotent hücre elde edilmesi
İnsan embryonik kök hücre üretimi fertilizasyon sonrası embriyonun farklı aşamalarından yapılabileceği gibi, en yaygın kullanılan yöntem blastosistevresindeki iç hücre kitlesinin izolasyonu ve in vitro ekspansiyonudur. iEKH: insan embriyonik kök hücreleri; ICM: ‘inner cell mass-iç hücre kitlesi.
Çekirdek transferi, hücre füzyonu ve transkripsiyon faktörlerinin ektopik ekspresyonlarının sağlandığı araştırmalara kadar, terminal farklılaşmasınıtamamlamış hücrelerin kaderinin değişemeyeceği düşünülmekteydi. Ancak özelleşmiş somatik hücrelerin embriyonik hücrelerin içerdiği tüm genetikbilgiye sahip olduğu ve uygun koşullar sağlandığında (mikroçevre, gen ifadesinin değişimi vb.) embriyonik karakterdeki hücrelere dönüşebilecekleri gösterilmiştir [6,35,36]. İn vitro ve in vivo embriyonik kök hücrelerin pluripotent özelliği Nanog, Sox-2 ve Oct-4 transkripsiyon faktörlerinin eşzamanlı ekspresyonlarına dayanır ancak in vivo embriyonik kök hücrelerin pluripotent özelliği bu hücrelerin kendi kendilerini yenileyememeleri nedeniyle gelişimin ilerleyen aşamalarında kaybolmaktadır [37]. İn vitro embriyonik kök hücrelerin ise besleyici hücrelerle kültüre edildiklerinde pluripotent karakterlerini sınırsız bölünebilme kapasiteleri ile korudukları gösterilmiştir [38]. Normal karyotipini koruyarak kendikendini yenileyebilen embriyonik kök hücrelerin pluripotent özellikleri, in vivo olarak ağır kombine immün yetmezlik sendromu (SCID) gösteren farenin testis kapsülüne enjekte edilmeleri sonrasında, üç germ tabakasnı temsil eden hücreleri içeren teratoma oluşturmaları ile gösterilir [39,40]. İn vitro farklılaşma potansiyeli ise uygun kültür koşullarının (besleyici hücreler, büyüme faktörleri) ortamdan kaldırılması ile embriyonik kök hücrelerin üç boyutlı agregatları yani ‘embrioid cisimcikleri’ oluşturmaları ile gösterilebilir. Embrioid cisimcikler morfolojik olarak,merkezi kavitenin primitif endoderm benzeri hücre katmanıyla çevrelendiği hücre yığınlarına benzerler ve ortalama 21 gün sonrasında endoderm, mezoderm ve ektoderm tabakalarına ait hücre tiplerine özgün moleküler belirteçleri eksprese ederler [41,42]. Embriyonik kök hücrelerin kültür ortamında ve iç hücre kitlesinde epigenetik yönden de farklılık gösterdikleri bilinmektedir. İn vitro pluripotent hücrelerin genomlarında yüksek metilasyon görülürken, embriyogenezde iç hücre kitlesini oluşturan hücrelerde metilasyonun düşük derecede olduğu gösterilmiştir [43].
Pluripotent hücreler fare embriyosunun farklı aşamalarından elde edilebilirler. Epiblast kök hücreleri olarak adlandırılan bu hücre grubu embriyo implantasyonundan sonra (5.5-7.5 günler) iç hücre kitlesinden farklılaşarak epiblastı oluşturan epitelyal hücrelerden elde edilirler. İnsan embriyonikkök hücreleri gibi in vitro kültür ortamında FGF2 (Fibroblast büyüme faktörü 2) ve Aktivin desteğine ihtiyaç duyarlar, pluripotenttirler ve embrioid cisimcik-teratoma oluşumu gösterirler [44]. Her ne kadar pluripotent hücreler olarak değerlendirilseler de sınırlı farklılaşma potansiyelleri vardır, X kromozomu inaktivasyonu gösterirler ve kimerik canlı oluşturmada embriyonik kök hücreler kadar etkin değillerdir [45]. Fare embriyosundaki (8.5 gün) primordial germ hücrelerinin de embriyonik kök hücrelere benzer karakterde olduğu ve in vitro kültür sonrasında teratoma ve kimerik canlı oluşturma potansiyeline sahip olduğu gösterilmiştir [46]. Tüm bu pluripotent hücre tiplerinde, pluripotent özelliğin kontrolü ve devamının sağlanmasında rol alan evrensel bir mekanizmanın var olup olmadığı henüz bilinmemekle birlikte, şimdiye kadar birçok intrinsik ve ekstrinsik faktörün pluripotent özelliği sağlanması için gerekli olduğu tespit edilmiştir.Oct-4 tüm pluripotent hücrelerde eksprese edilen POU (Pit-1, Oct-1, Oct-2, and Unc-86) domaini içeren transkripsiyon faktörüdür ve ekstraembriyonik dokuların oluşması ile ekspresyonunun düştüğü görülmüştür [22,47]. Başlangıçta tüm blastomerlerde görülen ekspresyon, blastosist evresinde iç hücrekitlesindeki hücrelerle sınırlı kalır ve erişkin memeli organizmalarda Oct-4 ekspresyonu yalnızca germ hücrelerinde görülür [48].
Oct-4 ekspresyon kaybı, fare embryolarında gelişimin durmasına, iç hücre kitlesindeki hücrelerin pluripotent özelliklerini kaybetmelerine ve yalnızca trofektodermin gelişmesine neden olur [22]. Oct-4’ün aşırı ekspresyonu ise endodermal ve mezodermal farklılaşma ile sonuçlanır [49]. Sox-2 de, Oct-4 gibi pluripotent özelliğin sağlanması için gereklidir. Sox-2 ekspresyonu oositte başlar, iki hücreli embriyoda görülür, 4 ve 8 hücreli aşamalardan morula evresine kadar ekspresyonu artarak devam eder ve blastosist evresinde iç hücre kitlesinde görülmekle birlikte bazı trofektoderm hücrelerinde de eksprese edildiği bilinmektedir [23,50]. Preimplantasyon fare embriyolarında Sox-2 ekspresyonunun inhibisyonu morula aşamasından öteye geçilememesiyle sonuçlanır [50]. İn vitro Sox-2 inhibisyonu sonucunda ise trofektoderm farklılaşması görülür [51]. Sox-2 ve Oct-4’ün dimer oluşturarak aralarında Nanog’un da olduğu birçok genin ekspresyonunu yönettiği bilinmektedir [52]. Nanog ekspresyonu morula aşamasında başlar, blastosist evresinde iç hücre kitlesindeki hücrelerde görülür ve sonrasında ekspresyonu epiblastla sınırlı kalır [53,54]. Nanog’un aşırı ekspresyonu fare ve insan embriyonik kök hücrelerinde büyüme faktörü eklen mesine gerek kalmadan in vitro pluripotent özelliğin korunması için yeterlidir [54,55]. Buna karşın, Na nog gen delesyonu ile ekstraembriyonik dokulara farklılaşma ve Oct-4, SSEA-4 transkripsiyonlarında azalma görülür [54,56].
Mitsui ve ark. (2003) fare embriyonik ve epiblast kök hücrelerinde pluripotent olmayan hücrelere oranla artmış ekspresyonu görülen 20 civarında geni belirlemesiyle başlayan çalışmalar sonrasında Takahashi ve Yamanaka’nın fare fibroblastlarında bu faktörlerin farklı kombinasyonlarını kullanıp somatik hücrelerden indüklenmiş pluripotent kök hücreler elde etmeleriyle, pluripotent özelliğin intrinsik kontrol mekanizmasına ait önemli ipuçları elde edilmiştir [6,54]. Oct-4, Sox-2, Klf-4, c-Myc, Lin 28 ve Nanog somatik hücrelerin yeniden programlanmasında kullanılan başlıca transkripsiyon faktörleri olarak belirlense de, özellikle histon modifikasyonlarını değiştiren kimyasal maddelerin ve hücrelerin bulunduğu kültür koşullarının (sitokinler, büyüme faktörleri, serum, besleyici hücreler vb.) da pluripotent özelliğin kazanılması ve korunması için önemli olduğu görülmüştür (Şekil 2) [16,57-59].

Şekil 2.
Somatik hücrelerin yeniden programlanarak pluripotent özellik kazanmaları. da pluripotent özelliğin kazanılması ve korunması için önemli olduğu görülmüştür (Şekil 2) [16,57-59].
Hücre dışı faktörlerin pluripotent özelliği nasıl etkilediği henüz bilinmemekle birlikte, bu sinyallerin pluripotent özellik genlerini aktive ettiği ve farklılaş mayı sağlayan genleri baskıladığı düşünülmektedir [58,60]. Örneğin; LIF aracılı sinyal mekanizmasının transkripsiyon faktörü STAT3’ü ve ona bağlı pluripotent özellikle ilgili genleri aktive ettiği bilinmektedir [61,62]. Yine, TGFβ/Aktivin/Nodal ve BMP (kemik morfogenetik protein) sinyal yolaklarının embriyonik kök hücrelerin ve pluripotent özelliğin sağlanmasında rol aldığı bilinmektedir [63]. TGFβ/Aktivin/Nodal sinyal mekanizmasının Smad 2/3 fosforilasyonuna neden olarak Oct-4 ve Nanog gibi pluripotent özellikle ilgili genlerin ekspresyonunu etkilediği gösterilmiştir [64,65]. Nodal, pluripotent insan embriyonik kök hücrelerinde aşırı eksprese edilir ve farklılaşma sonrasında Nodal gen ifadesinde azalma görülür [66]. Aktivin, pluripotent kök hücrelerin in vitro kültür ortamında kullanılan fare embriyonik kök hücrelerinden elde edilen besiyeri içeriğinde yüksek oranda bulunmaktadır [63,67]. Aktivinin in vitro kültür ortamından uzaklaştırılması insan embriyonik kök hücrelerin pluripotent özelliklerini kaybedip farklılaşmalarıyla sonuçlanır [67]. Aktivinin pluripotent özellik üzerindeki bu etkisi, Nanog gen ifadesini direkt olarak Smad 2/3 fosforilasyonunu etkileyerek düzenlemesine bağlıdır [68]. BMP-4 sinyal yolağının ise insan embriyonik kök hücrelerinde Oct-4 ve Nanog ekspresyonunu azalttığı ve farklılaşmayı indüklediği gösterilmiştir [69].
Pluripotent özelliğin terminal farklılaşmasını tamamlamış somatik hücrelere kazandırılması yeniden programlama faktörleri kullanılarak gerçekleştirilebilir. İndüklenmiş pluripotent hücreler embriyonik pluripotent hücrelerdeki kendi kendini sınırsız yenileyebilme ve embriyonik dokulara farklılaşabilme özelliklerine sahip olmalarına rağmen epigenetik farklılıklar nedeniyle tam anlamıyla bir yeniden programlama bugünkü mevcut sistemlerle mümkün gibi görünmemektedir.
FGF-2 (fibroblast büyüme faktörü), insan embriyonik kök hücrelerinin pluipotent özelliğinin korunmasında etkili diğer dış faktördür. FGF ailesine ait ligandlar tirozin kinaz aktivitesine sahip dört farklı reseptör üzerinden etkilerini göstererek MAPK, ERK (ekstrasellüler sinyalle düzenlenen kinaz) 1/2, PI-3K/Akt (fosfatidilinozitol-3’ kinaz/Akt) gibi hücre içi sinyal moleküllerini aktive ederler [70,71]. Bu moleküller insan embriyonik kök hücre farklılaşması, çoğalması ve pluripotent özelliğini etkileyen gen ifa desini düzenlerler [63]. İn vitro insan embriyonik kök hücre kültüründe FGF-2 takviyesi pluripotent özelliğin devamı için şarttır ve pluripotent insan embriyonik kök hücrelerinin, FGF reseptörleri ile ligandlarını ifade ettiği gösterilmiştir [72-75]. Aktivin A’nın asıl etkisinin, BMP’nin baskılanmasının yanında insan embriyonik kök hücrelerinde FGF-2 ekspresyonunun indüklenmesiyle gösterildiği bilinmektedir [76]. FGF-2’nin pluripotent özellik üzerinde pozitif etkilerinin gösterebilmesi aynı zamanda aktif bir TGFβ/Aktivin/Nodal sinyal mekanizmasına bağlıdır. Aktivin, Nodal ve TGF-β1 reseptörleri olan ALK-4, -7 ve -5’in inhibisyonu sonucunda farklılaşan insan embriyonik kök hücrelerin pluripotent karakteri, besiyerine FGF-2 desteğine rağmen kurtarılamaz [77]. Bu durum, ne FGF-2’nin ne de Aktivin A’nın tek başına in vitro pluripotent kök hücre kültürünü destekleyemediğini göstermektedir [68,78]. FGF-2 ile aktive olan sinyal moleküllerinden PI-3K/Akt’nin inhibisyonu, insan embriyonik kök hücrelerde pluripotent özelliğin kaybına neden olur [79,80]. PI-3K sinyal yolu Aktivin ve Nodal’ın insan embriyonik kök hücreleri üzerindeki farklılaştırma etkisini baskılayarak pluripotent özelliğin korunmasına yardımcı olur [81]. Birbirinden bağımsız iki dış faktörün pluripotent özelliğin devamını sağlamak için bir denge içerisinde çalışması gereklidir. Son yıllarda bu mekanizma PI-3K/ Akt’nin doğrudan Raf molekülüne bağlanıp Raf/MEK/ERK sinyal yolağını baskılaması ve bunun üzerine GSK3β’nın inaktivasyonunun artarak düşük β-katenin seviyesine neden olmasıyla açıklanmıştır. Azalan β-katenin seviyesi Smad 2/3 aracılı mezendodermal farklılaşmaya izin vermez ve bu şekilde pluripotent özellik devam ettirilmiş olur [82,83]. Özetle, in vitro kültür sistemlerinde kullanılan FGF ve Aktivin moleküllerinin aktive ettikleri sinyal mekanizmaları ortaklaşa çalışarak pluripotent özelliğin korunmasında görev alırlar, in vitro kültür ortamında bu faktörler arasındaki dengenin artma ya da azalma yönünde bozulması halinde pluripotent özellik kaybolarak, farklılaşma ile ilgili sinyal mekanizmaları aktive edilir. Tüm bu bilgiler ışığında, pluripotent özelliğin son derece karmaşık bir mekanizma ile yönetildiği söylenebilir. Bu nedenle indüklenmiş pluripotent kök hücre üretilmesinde yalnızca genetik faktörlerin değil, hücre dışı faktörlerin de etkisinin hesaba katılması, uzun süreli ve karyotipik olarak normal pluripotent hücre dizilerinin elde edilmesi ve tedaviye yönelik kullanımları açısından önemlidir.
Kaynak:
1. Thomson JA, Itskovitz-Eldor J, Shapiro SS, et al. Embryonic stem cell lines derived from human blastocysts. Science 1998;282:1145-1147.
2. Condic ML, Rao M. Alternative sources of pluripotent stem cells: ethical and scientific issues revisited. Stem Cells Dev 2010;19:1121-1129.
3. Gurdon JB, Melton DA. Nuclear reprogramming in cells. Science 2008;322:1811-1815.
4. Cowan CA, Atienza J, Melton DA, Eggan K. Nuclear reprogramming of somatic cells after fusion with human embryonic stem cells. Science 2005;309:1369-1373.
5. Wilmut I, Schnieke AE, Mcwhir J, Campbell KHS. Viable offspring derived from fetal and adult mammalian cells. Nature 1997;385:810-813.
6. Takahashi K, Yamanaka S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell 2006;126:663-676.
7. Takahashi K, Tanabe K, Ohnuki M, et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell 2007;131:861-872.
8. Stadtfeld M, Nagaya M, Utikal J, et al. Induced pluripotent stem cells generated without viral integration. Science 2008;322:945-949.
9. Yu J, Vodyanik MA, Smuga-Otto K, et al. Induced pluripotent stem cell lines derived from human somatic cells. Science 2007;318:1917-1920.
10. Fusaki N, Ban H, Nishiyama A, et al. Efficient induction of transgene-free human pluripotent stem cells using a vector based on Sendai virus, an RNA virus that does not integrate into the host genome. Proc Jpn Acad Ser B Phys Biol Sci 2009;85:348-462.
11. Okita K, Hong H, Takahashi K, Yamanaka S. Generation of mouse-induced pluripotent stem cells with plasmid vectors. Nat Protoc 2010;5:418-428.
12. Woltjen K, Michael IP, Mohseni P, et al. piggyBac transposition reprograms fibroblasts to induced pluripotent stem cells. Nature 2009;458:766-770.
13. Osteil P, Tapponnier Y, Markossian S, et al. Induced pluripotent stem cells derived from rabbits exhibit some characteristics of naïve pluripotency. Biol Open 2013;2:613-628.
14. Liu H, Zhu F, Yong J, et al. Generation of induced pluripotent stem cells from adult rhesus monkey fibroblasts. Cell Stem Cell 2008;3:587-590.
15. Jia F, Wilson KD, Sun N, et al. A nonviral minicircle vector for deriving human iPS cells. Nat Methods 2010;7:197-199.
16. Huangfu D, Osafune K, Maehr R, et al. Induction of pluripotent stem cells from primary human fibroblasts with only Oct4 and Sox2. Nat Biotechnol 2008;26:1269-1275.
17. Kim D, Kim CH, Moon JI, et al. Generation of human induced pluripotent stem cells by direct delivery of reprogramming proteins. Cell Stem Cell 2009;4:472-476.
18. Pandian GN, Nakano Y, Sato S, et al. A synthetic small molecule for rapid induction of multiple pluripotency genes in mouse embryonic fibroblasts. Sci Rep 2012;2:544.
19. Zhang Z, Gao Y, Gordon A, et al. Efficient generation of fully reprogrammed human iPS cells via polycistronic retroviral vector and a new cocktail of chemical compounds. PloS One 2011;6:e26592.
20. Li W, Ding S. Small molecules that modulate embryonic stem cell fate and somatic cell reprogramming. Trends Pharmacol Sci 2010;31:36-45.
21. Yan X, Qin H, Qu C, et al. iPS cells reprogrammed from human mesenchymal-like stem/progenitor cells of dental tissue origin. Stem Cells Dev 2010;19:469-480.
22. Nichols J, Zevnik B, Anastassiadis K, et al. Formation of pluripotent stem cells in the mammalian embryo depends on the POU transcription factor Oct4. Cell 1998;95:379-391.
23. Avilion AA, Nicolis SK, Pevny LH, et al. Multipotent cell lineages in early mouse development depend on SOX2 function. Genes Dev 2003;17:126-140.
24. Chambers I, Silva J, Colby D, et al. Nanog safeguards pluripotency and mediates germline development. Nature 2007;450:1230-1234.
25. Adhikary S, Eilers M. Transcriptional regulation and transformation by Myc proteins. Nat Rev Mol Cell Biol 2005;6:635-645.
26. Rowland BD, Bernards R, Peeper DS. The KLF4 tumour suppressor is a transcriptional repressor of p53 that acts as a context-dependent oncogene. Nat Cell Biol 2005;7:1074-1082.
27. Li Y, McClintick J, Zhong L, et al. Murine embryonic stem cell differentiation is promoted by SOCS-3 and inhibited by the zinc finger transcription factor Klf4. Blood 2005;105:635-637.
28. Cartwright P, McLean C, Sheppard A, et al. LIF/STAT3 controls ES cell self-renewal and pluripotency by a Myc-dependent mechanism. Development 2005;132:885-896.
29. Wernig M, Meissner A, Foreman R, et al. In vitro reprogramming of fibroblasts into a pluripotent ES-cell-like state. Nature 2007;448:318-324.
30. Maherali N, Sridharan R, Xie W, et al. Directly reprogrammed fibroblasts show global epigenetic remodeling and widespread tissue contribution. Cell Stem Cell 2007;1:55-70.
31. Rao M. Conserved and divergent paths that regulate self-renewal in mouse and human embryonic stem cells. Dev Biol 2004;275:269-286.
32. Kuijk EW, Chuva de Sousa Lopes SM, Geijsen N, et al. The different shades of mammalian pluripotent stem cells. Hum Reprod Update 2011;17:254-271.
33. Tarnowski M, Sieron AL. Adult stem cells and their ability to differentiate. Med Sci Monit 2006;12:154-163.
34. Reubinoff BE, Pera MF, Fong CY, et al. Embryonic stem cell lines from human blastocysts: somatic differentiation in vitro. Nat Biotechnol 2000;18:399-404.
35. Blau HM, Chiu CP, Webster C. Cytoplasmic activation of human nuclear genes in stable heterocaryons. Cell 1983;32:1171-1180.
36. Wakayama T, Perry AC, Zuccotti M, et al. Full-term development of mice from enucleated oocytes injected with cumulus cell nuclei. Nature 1998;394:369-374.
37. Nichols J, Smith A. Naive and primed pluripotent states. Cell Stem Cell 2009;4:487-492.
38. Pera MF, Reubinoff B, Trounson A. Human embryonic stem cells. J Cell Sci 2000;113:5-10.
39. Keller G. Embryonic stem cell differentiation: emergence of a new era in biology and medicine. Genes Dev 2005;19:1129-1155.
40. Stojkovic M, Lako M, Stojkovic P, et al. Derivation of human embryonic stem cells from day-8 blastocysts recovered after three-step in vitro culture. Stem Cells 2004;22:790-797.
41. Khoo ML, McQuade LR, Smith MS, et al. Growth and differentiation of embryoid bodies derived from human embryonic stem cells: effect of glucose and basic fibroblast growth factor. Biol Reprod 2005;73:1147-1156.
42. Itskovitz-Eldor J, Schuldiner M, Karsenti D, et al. Differentiation of human embryonic stem cells into embryoid bodies compromising the three embryonic germ layers. Mol Med 2000;6:88-95.
43. Meissner A, Mikkelsen TS, Gu H, et al. Genome-scale DNA methylation maps of pluripotent and differentiated cells. Nature 2008;454:766-770.
44. Brons IG, Smithers LE, Trotter MW, et al. Derivation of pluripotent epiblast stem cells from mammalian embryos. Nature 2007;448:191-195.
45. Tesar PJ, Chenoweth JG, Brook FA, et al. New cell lines from mouse epiblast share defining features with human embryonic stem cells. Nature 2007;448:196-199.
46. Matsui Y, Zsebo K, Hogan BL. Derivation of pluripotential embryonic stem cells from murine primordial germ cells in culture. Cell 1992;70:841-847.
47. Johnson BV, Rathjen J, Rathjen PD. Transcriptional control of pluripotency: decisions in early development. Curr Opin Genet Dev 2006;16:447-454.
48. Boyer LA, Mathur D, Jaenisch R. Molecular control of pluripotency. Curr Opin Genet Dev 2006;16:455-462.
49. Niwa H, Miyazaki J, Smith AG. Quantitative expression of Oct-3/4 defines differentiation, dedifferentiation or self-renewal of ES cells. Nat Genet 2000;24:372-376.
50. Keramari M, Razavi J, Ingman KA, et al. Sox2 is essential for formation of trophectoderm in the preimplantation embryo. PloS One 2010;5:e13952.
51. Masui S, Nakatake Y, Toyooka Y, et al. Pluripotency governed by Sox2 via regulation of Oct3/4 expression in mouse embryonic stem cells. Nat Cell Biol 2007;9:625-635
52. Rodda DJ, Chew JL, Lim LH, et al. Transcriptional regulation of nanog by OCT4 and SOX2. J Biol Chem 2005;280:24731-24737.
53. Hart AH, Hartley L, Ibrahim M, Robb L. Identification, cloning and expression analysis of the pluripotency promoting Nanog genes in mouse and human. Dev Dyn 2004;230:187-198.
54. Mitsui K, Tokuzawa Y, Itoh H, et al. The homeoprotein Nanog is required for maintenance of pluripotency in mouse epiblast and ES cells. Cell 2003;113:631-642.
55. Darr H, Mayshar Y, Benvenisty N. Overexpression of NANOG in human ES cells enables feeder-free growth while inducing primitive ectoderm features. Development 2006;133:1193-1201.
56. Hyslop L, Stojkovic M, Armstrong L, et al. Downregulation of NANOG induces differentiation of human embryonic stem cells to extraembryonic lineages. Stem Cells 2005;23:1035-1043.
57. Nakagawa M, Koyanagi M, Tanabe K, et al. Generation of induced pluripotent stem cells without Myc from mouse and human fibroblasts. Nat Biotechnol 2008;26:101-106.
58. Feng B, Jiang J, Kraus P, et al. Reprogramming of fibroblasts into induced pluripotent stem cells with orphan nuclear receptor Esrrb. Nat Cell Biol 2009;11:197-203.
59. Feng B, Ng JH, Heng JC, Ng HH. Molecules that promote or enhance reprogramming of somatic cells to induced pluripotent stem cells. Cell Stem Cell 2009;4:301-312.
60. Peerani R, Rao BM, Bauwens C, et al. Niche-mediated control of human embryonic stem cell self-renewal and differentiation. EMBO J 2007;26:4744-4755.
61. Chen X, Xu H, Yuan P, et al. Integration of external signaling pathways with the core transcriptional network in embryonic stem cells. Cell 2008;133:1106-1117.
62. Sekkaï D, Gruel G, Herry M, et al. Microarray analysis of LIF/Stat3 transcriptional targets in embryonic stem cells. Stem Cells 2005;23:1634-1642.
63. Stewart RS, Stojkovic M, Lako M. Mechanisms of selfrenewal in human embryonic stem cells. Eur J Cancer 2006;42:1257-1272.
64. James D, Levine AJ, Besser D, Hemmati-Brivanlou A. TGFbeta/activin/nodal signaling is necessary for the maintenance of pluripotency in human embryonic stem cells. Development 2005;132:1273-1282.
65. Xu RH, Sampsell-Barron TL, Gu F, et al. NANOG is a direct target of TGFbeta/activin-mediated SMAD signaling in human ESCs. Cell Stem Cell 2008;3:196-206.
66. Vallier L, Reynolds D, Pedersen RA. Nodal inhibits differentiation of human embryonic stem cells along the neuroectodermal default pathway. Dev Biol 2004;275:403-421.
67. Beattie GM, Lopez AD, Bucay N, et al. Activin A maintains pluripotency of human embryonic stem cells in the absence of feeder layers. Stem Cells 2005;23:489-495.
68. Vallier L, Mendjan S, Brown S, et al. Activin/Nodal signalling maintains pluripotency by controlling Nanog expression. Development 2009;136:1339-1349.
69. Zhang P, Li J, Tan Z, et al. Short-term BMP-4 treatment initiates mesoderm induction in human embryonic stem cells. Blood 2008;111:1933-1941.
70. Lanner F, Rossant J. The role of FGF/Erk signaling in pluripotent cells. Development 2010;137:3351-3360.
71. Dailey L, Ambrosetti D, Mansukhani A, Basilico C. Mechanisms underlying differential responses to FGF signaling. Cytokine Growth Factor Rev 2005;16:233-247.
72. Dvorak P, Dvorakova D, Koskova S, et al. Expression and potential role of fibroblast growth factor 2 and its receptors in human embryonic stem cells. Stem Cells 2005;23:1200-1211.
73. Ding VMY, Boersema PJ, Foong LY, et al. Tyrosine phosphorylation profiling in FGF-2 stimulated human embryonic stem cells. PloS One 2011;6:e17538.
74. Amit M, Shariki C, Margulets V, Itskovitz-Eldor J. Feeder layer- and serum-free culture of human embryonic stem cells. Biol Reprod 2004;70:837-845.
75. Wang G, Zhang H, Zhao Y, et al. Noggin and bFGF cooperate to maintain the pluripotency of human embryonic stem cells in the absence of feeder layers. Biochem Biophys Res Commun 2005;330:934-942.
76. Xiao L, Yuan X, Sharkis SJ. Activin A maintains selfrenewal and regulates fibroblast growth factor, Wnt, and bone morphogenic protein pathways in human embryonic stem cells. Stem Cells 2006;24:1476-1486.
77. Vallier L, Alexander M, Pedersen RA. Activin/Nodal and FGF pathways cooperate to maintain pluripotency of human embryonic stem cells. J Cell Sci 2005;118:4495-4509.
78. Baxter MA, Camarasa MV, Bates N, et al. Analysis of the distinct functions of growth factors and tissue culture substrates necessary for the long-term self-renewal of human embryonic stem cell lines. Stem Cell Res 2009;3:28-38.
79. Armstrong L, Hughes O, Yung S, et al. The role of PI3K/AKT, MAPK/ERK and NFkappabeta signalling in the maintenance of human embryonic stem cell pluripotency and viability highlighted by transcriptional profiling and functional analysis. Hum Mol Genet 2006;15:1894-1913.
80. Pyle AD, Lock LF, Donovan PJ. Neurotrophins mediate human embryonic stem cell survival. Nat Biotechnol 2006;24:344-350.
81. McLean AB, D’Amour KA, Jones KL, et al. Activin a efficiently specifies definitive endoderm from human embryonic stem cells only when phosphatidylinositol 3-kinase signaling is suppressed. Stem Cells 2007;25:29-38.
82. Chen YG, Li Z, Wang XF. Where PI3K/Akt meets Smads: the crosstalk determines human embryonicstem cell fate. Cell Stem Cell 2012;10:231-232.
83. Li L, Wang S, Jezierski A, et al. A unique interplay between Rap1 and E-cadherin in the endocytic pathway regulates self-renewal of human embryonic stem cells. Stem Cells 2010;28:247-257.
84. Park IH, Lerou PH, Zhao R, et al. Generation of human-induced pluripotent stem cells. Nat Protoc 2008;3:1180-1186.
85. Gurdon JB, Els dale TR, Fischberg M. Sexually mature individuals of Xenopus laevis from the transplantation of single somatic nuclei. Nature 1958;182:64-5.
86. Campbell KH, McWhir J, Ritchie WA, Wilmut I. Sheep cloned by nuclear transfer from a cultured cell line. Nature 1996;380:64-6.
87. Takahashi K, Yamanaka S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell 2006;126:663-76.
88. Takahashi, K, Tanabe K, Ohnuki M, Narita M, Ichisaka T, Tomoda K, Yamanaka S. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell 2007;131:861-72.
89. Yu J, Vodyanik MA, Smuga-Otto K, Antosiewicz-Bourget J, Frane JL, Tian S, Nie J, Jonsdottir GA, Ruotti V, Stewart R, Slukvin II, Thomson JA. Induced pluripotent stem cell lines derived from human somatic cells. Science 2007;318:1917-20.
90. Park IH, Zhao R, West JA, Yabuuchi A, Huo H, Ince TA, Lerou PH, Lensch MW, Daley GQ. Reprogramming of human somatic cells to pluripotency with defined factors. Nature 2008;451:141-6.
- Türk Hematoloji Derneği 2004 4-2 Dr. Salih Kozan, Dr. Ali Öztuna "İndüklenmiş pluripotent kök hücre, Pluripotensi, Yeniden programlama, Rejeneratif tıp"
- Journal of Clinical and Experimental Investigations Banu İskender, Halit Canatan "İndüklenmiş pluripotent kök hücreler ve hücre tedavisi"2013; 4 (4): 550-561 doi: 10.5799/ahinjs.01.2013.04.0346
Embriyoloji
-
İndüklenmiş pluripotent kök hücreler
-
HAYVANLARDA ÜREME
-
OMURGALILARDA ÜREME SİSTEMLERİ
-
OMURGALI HAYVANLARDA ÜREME
-
OMURGASIZ HAYVANLARDA ÜREME
-
Embriyo nedir?
-
GAMETLERİN OLUŞUMU
-
Zigotun Yarıklanması
-
KAN DAMARLARININ ve DOLAŞIMIN OLUŞUMU ( anjiogenezis )
-
GELİŞME ve BÜYÜME
-
İNSANDA ÜREME SİSTEMİ
-
Fetal Fizyolojisi
-
Emriyoloji Sunumu
-
Sperm Morfolojisi
-
İNSANDA EMBRİYOLOJİK GELİŞİM